Bon nombre de dispositifs médicaux sont de nature invasive et servent à sonder le corps humain de diverses manières. Certains permettent dʼexplorer lʼanatomie, dʼôter des tumeurs et de réparer des organes ou tissus endommagés, alors que dʼautres demeurent à lʼintérieur du corps, comme une prothèse de hanche, un stent vasculaire, une valve cardiaque artificielle ou un pacemaker.

Le secteur des dispositifs médicaux, qui doit concilier des caractéristiques de conception et de performance conformes aux normes les plus élevées et un modèle opérationnel complexe de soins de santé (sans parler des exigences strictes de la réglementation dans ce domaine), est lʼun des plus complexes et exigeants en matière de produits manufacturés.
Pour arriver à gérer tous ces paramètres, explique le Dr. Eamonn Hoxey, Vice-président, Programmes stratégiques de la qualité et de la conformité des dispositifs médicaux, chez Johnson & Johnson, les normes ISO se révèlent essentielles. Elles permettent de commercialiser des dispositifs médicaux de qualité et dʼassurer leur maintien tout au long de leur cycle de vie.
En tant que Président du comité technique ISO/TC 210, Management de la qualité et aspects généraux correspondants des dispositifs médicaux, il souligne également que les normes ISO peuvent étayer les exigences réglementaires encadrant la sécurité et la performance de ces appareils. Voici donc les dernières tendances en matière de normalisation des dispositifs médicaux qui, selon le Dr. Hoxey, reflètent le changement dynamique qui se produit actuellement dans ce secteur.
ISOfocus : Comment parvenez-vous à déterminer quʼun dispositif médical ne présente aucun risque pour le patient ?
Dr. Eamonn Hoxey : Nous appliquons une démarche systématique de management du risque tout au long du cycle de vie dʼun dispositif médical. Lors de la phase de conception et de développement initiale, nous déterminons les risques en matière de sécurité et de performance et mettons au point des mesures destinées à les éliminer ou à les atténuer. Une fois conçu, le dispositif médical est soumis à des vérifications et des validations rigoureuses pour démontrer lʼefficacité des moyens de maîtrise des risques qui ont été introduits et confirmer si un éventuel risque résiduel peut être acceptable au regard des bénéfices cliniques. Enfin, lors de la phase dʼutilisation, le dispositif médical fait lʼobjet dʼune surveillance supplémentaire afin de déterminer tout risque non décelé, ainsi que lʼefficacité de la maîtrise des risques mise en place, de sorte que des mesures puissent être prises pour faire face aux éventualités imprévues.
LʼISO/TC 210 a élaboré des normes visant à appuyer les exigences réglementaires ayant trait à la sécurité et la performance des dispositifs médicaux. La conception et le développement de ces appareils relèvent du système de management de la qualité (SMQ) du fabricant et ISO 13485 fournit les exigences relatives au processus de conception et de développement, y compris à lʼintégration du management du risque. En outre, la norme couvre lʼanalyse des retours dʼinformation au cours de la phase dʼutilisation, ainsi que la conduite dʼune surveillance post-commercialisation. Jouant un rôle de complément efficace, ISO 14971 offre une description dʼune démarche systématique de gestion des risques qui peut être appliquée tout au long du cycle de vie du dispositif médical.

Dans quelle mesure les normes ISO influent-elles sur la sécurité, la qualité et la fiabilité de nos services de santé ?
Le terme « services de santé » englobe lʼensemble des aspects de la prestation de soins de santé aux patients dans une large gamme de contextes : services hospitaliers, laboratoires, traitements en ambulatoire, chirurgie générale, soins à domicile, premiers secours, etc. Le cycle de vie des technologies de la santé représente un domaine particulier où interviennent de manière importante les normes ISO : de la conception à lʼélaboration, jusquʼà la chaîne dʼapprovisionnement et à lʼutilisation.
Les technologies des soins de santé sont utilisées tout au long de la prestation de services de santé et leur domaine dʼapplication est, par conséquent, très vaste : imagerie médicale sophistiquée à des fins de diagnostic, matériel de laboratoire, appareils destinés aux interventions chirurgicales, produits dʼaide à la vie quotidienne, et produits en vente libre dans une gamme de commerces au détail. La technologie des soins de santé est essentielle au fonctionnement efficace et rentable de la prestation des soins et contribue quotidiennement à lʼamélioration des conditions des patients et des soignants.
Une vaste gamme de normes ISO sont employées pour le cycle de vie des technologies des soins de santé. Le comité technique ISO/TC 210 intervient dans un certain nombre de domaines généraux qui couvrent tout un ensemble de produits. Il existe, par exemple, des normes portant sur un SMQ destiné à faciliter la mise en œuvre des exigences réglementaires, sur des processus de management du risque employés pour le cycle de vie de dispositifs médicaux, sur des symboles à utiliser pour indiquer des informations essentielles sur les étiquettes en évitant de les traduire en plusieurs langues, ainsi que sur des raccords de petite taille entrant dans lʼutilisant combinée de plusieurs dispositifs médicaux pour le traitement dʼun patient.
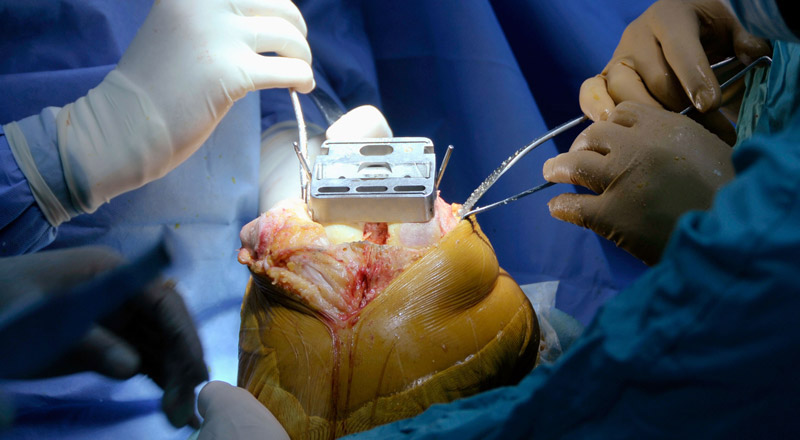
Les dispositifs médicaux jouent un rôle croissant dans la transformation de la prestation des soins. Toutefois, le problème dʼinteropérabilité ou de raccordement entre les dispositifs peut faire courir des risques vitaux aux patients. Pourriez-vous nous en dire plus ?
Les dispositifs médicaux sont un rouage essentiel dans la prestation de soins de santé sûrs et imposent un niveau élevé de sécurité et de performance. À mesure que lʼenvironnement clinique se complexifie et que la technologie se perfectionne, en particulier avec lʼinteraction de plusieurs dispositifs médicaux pour un seul patient, la nécessité de considérer le système dans son ensemble plutôt que les composantes individuelles devient plus grande.
Lʼapplication croissante dʼune approche axée sur les systèmes et la prise en considération dʼenjeux tels que les facteurs humains et lʼutilisabilité, dans la conception et le développement des dispositifs médicaux, revêtent, par conséquent, une importance grandissante. LʼISO/TC 210, conjointement avec lʼIEC/TC 62 relatif aux équipements électriques dans la pratique médicale, a élaboré un certain nombre de normes qui mettent en application des démarches systématiques en matière de management de la qualité, de management du risque et dʼutilisabilité. Il prépare notamment une série de normes portant sur les connecteurs de petite taille conçus pour réduire les risques de mauvais raccordement des dispositifs au niveau de lʼinterface patient.
Dans quelle mesure un SMQ est-il important pour les dispositifs médicaux ? Pourquoi était-il nécessaire de mettre à jour ISO 13485 ? Quelles nouveautés apporte la version révisée ?
Un SMQ représente un élément crucial des dispositifs médicaux. Celui-ci est exigé par la réglementation de la plupart des pays en vue dʼintégrer la maîtrise du cycle de vie dʼun produit. Il était donc nécessaire de mettre à jour ISO 13485 pour tenir compte des avancées technologiques les plus récentes et des attentes des fabricants et des autorités de réglementation. Cette révision présente les principaux avantages dʼaccroître la transparence relativement aux exigences, ainsi que de garantir une cohérence entre les autorités de réglementation, les organismes dʼaudit et les fabricants de dispositifs médicaux. On trouve, parmi les domaines qui ont été renforcés, lʼinteraction entre le SMQ et les exigences réglementaires, lʼapplicabilité de la norme tout au long du cycle de vie du dispositif médical, par exemple entre les distributeurs et les importateurs, et lʼintégration plus large de principes de management du risque dans lʼensemble du SMQ.
Comment expliquer la participation de Johnson & Johnson aux travaux de normalisation de lʼISO et quels avantages lʼentreprise peut-elle en retirer ?
Johnson & Johnson est heureuse de pouvoir prendre part à lʼélaboration de normes. Cʼest là une occasion dʼaborder des enjeux communs aux fabricants, aux autorités de réglementation et aux utilisateurs, afin de contribuer à la mise en place de solutions qui se révéleront avantageuses pour lʼensemble des parties et, ultimement, pour le bien du patient. En outre, cela représente une opportunité intéressante de perfectionnement professionnel pour notre personnel à mesure quʼil renforce ses connaissances techniques et ses qualités relationnelles.

